C 말단
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
C 말단은 폴리펩타이드 사슬의 한쪽 끝에 위치한 카복실기를 말하며, 단백질 합성 과정에서 N 말단에서 시작하여 C 말단 방향으로 진행된다. C 말단은 단백질의 유지 신호, 퍼옥시좀 표적 신호 역할을 하며, 번역 후 변형을 통해 지질 앵커, GPI 앵커, 메틸화 등의 과정을 거칠 수 있다. 일부 단백질의 C 말단 도메인(CTD)은 RNA 중합효소 II의 활성 조절 등 특수한 기능을 수행한다.
더 읽어볼만한 페이지
- 번역 후 변형 - 단백질 카보닐화
- 번역 후 변형 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 단백질 구조 - 메틸화
메틸화는 메틸기를 분자에 첨가하는 과정으로, 생물학에서 유전자 발현 조절 등 생명현상에 관여하고 유기화학에서 유기 합성에 활용되며, 다양한 생물종에 존재하는 중요한 생리적 과정이다. - 단백질 구조 - 녹색 형광 단백질
녹색 형광 단백질(GFP)은 해파리에서 발견된 단백질로, 특정 파장의 빛을 흡수하여 녹색 형광을 방출하며, 자체 발색단 형성 능력과 유전자 조작을 통한 개량형 개발로 생물학 연구에서 리포터 유전자로 널리 사용되지만, 실험 결과 해석 시 주의가 필요하고 대체 기술 또한 개발 중이다.
2. 화학
아미노산은 아미노기와 카복실기를 가지고 있으며, 탈수 반응을 통해 서로 연결되어 사슬을 형성한다. 이 과정에서 한 아미노산의 아미노기가 다음 아미노산의 카복실기에 결합한다. 이렇게 형성된 폴리펩타이드 사슬은 N 말단에서 시작하여 C 말단으로 합성된다.[1]
2. 1. 아미노산 연결과 C 말단
각 아미노산은 아미노기와 카복실기를 가지고 있다. 아미노산은 한 아미노산의 아미노기가 다음 아미노산의 카복실기와 탈수 반응(탈수 축합)을 통해 결합하여 사슬을 형성한다. 따라서 폴리펩타이드 사슬은 C 말단(결합되지 않은 카복실기)과 N 말단(결합되지 않은 아미노기)을 갖는다. 단백질 합성은 N 말단에서 시작하여 C 말단 방향으로 진행된다.[1]3. 기능
C 말단은 단백질의 기능, 위치, 번역 후 변형 등 다양한 생물학적 과정에서 중요한 역할을 한다.
C 말단에는 단백질 분류를 위한 세포내 단백질 유지 신호가 포함될 수 있다. 가장 일반적인 소포체 유지 신호는 C 말단에 있는 아미노산 서열 -KDEL(-라이신-아스파르트산-글루탐산-류신) 또는 -HDEL(-히스티딘-아스파르트산-글루탐산-류신)이다. 이는 단백질을 소포체에 유지시키고 분비 경로로 들어가는 것을 방지한다. C 말단 근처의 -SKL(-세린-리신-류신) 서열 또는 유사 서열은 퍼옥시좀 표적 신호 1로 작용하여 단백질을 퍼옥시좀으로 유도한다.
단백질의 C 말단은 번역 후에 변형될 수 있는데, 가장 일반적인 것은 막 관통 도메인 없이 단백질이 세포막에 삽입될 수 있도록 C 말단에 지질 앵커를 추가하는 것이다. 프레닐화와 GPI 앵커는 C 말단 변형의 대표적인 예시이다. 프레닐화는 C 말단 근처의 시스테인 잔기에 파르네실 또는 제라닐제라닐과 같은 아이소프레노이드 막 앵커가 추가되는 변형이다. 작은 막 결합 G 단백질은 주로 프레닐화 방식으로 변형된다. 글리코실포스파티딜이노시톨(GPI)은 포스포글리칸의 일종으로, 세포막에 단백질을 고정시키는 앵커 역할을 한다. GPI 앵커는 C 말단 프로펩타이드가 프로테아제에 의해 절단된 후 C 말단에 부착된다.[1]
일부 단백질의 C 말단 도메인(CTD)은 특수한 기능을 가진다. 인간의 경우, RNA 중합효소 II의 CTD는 일반적으로 Tyr-Ser-Pro-Thr-Ser-Pro-Ser 서열의 최대 52개 반복 서열로 구성된다.[7],[3],[5] 이를 통해 다른 단백질이 RNA 중합효소의 C 말단 도메인에 결합하여 중합효소 활성을 활성화할 수 있다. 이러한 도메인은 DNA 전사 개시, 캡핑, RNA 전사체에의 부착, 그리고 스플라이소좀에 대한 RNA 스플라이싱에 관여한다.[8],[4],[6]
3. 1. C 말단 유지 신호
단백질의 N 말단에는 종종 표적 신호가 포함되어 있지만, C 말단에는 단백질 분류를 위한 세포내 단백질 유지 신호가 포함될 수 있다. 가장 일반적인 소포체 유지 신호는 C 말단에 있는 아미노산 서열 -KDEL(Lys-Asp-Glu-Leu) 또는 -HDEL(His-Asp-Glu-Leu)이다. 이는 단백질을 소포체에 유지시키고 분비 경로로 들어가는 것을 방지한다.3. 2. 퍼옥시좀 표적 신호
C 말단 근처의 -SKL(세린-리신-류신) 서열 또는 유사 서열은 퍼옥시좀 표적 신호 1로 작용하여 단백질을 퍼옥시좀으로 유도한다.3. 3. C 말단의 변형
단백질의 C 말단은 번역 후에 변형될 수 있는데, 가장 일반적인 것은 막 관통 도메인 없이 단백질이 세포막에 삽입될 수 있도록 C 말단에 지질 앵커를 추가하는 것이다. 프레닐화와 GPI 앵커는 C 말단 변형의 대표적인 예시이다.3. 3. 1. 프레닐화
프레닐화는 C 말단 근처의 시스테인 잔기에 파르네실 또는 제라닐제라닐과 같은 아이소프레노이드 막 앵커가 추가되는 변형이다. 작은 막 결합 G 단백질은 주로 프레닐화 방식으로 변형된다.3. 3. 2. GPI 앵커
글리코실포스파티딜이노시톨(GPI)은 포스포글리칸의 일종으로, 세포막에 단백질을 고정시키는 앵커 역할을 한다. GPI 앵커는 C 말단 프로펩타이드가 프로테아제에 의해 절단된 후 C 말단에 부착된다.[1] 이 변형의 대표적인 예로는 프리온 단백질이 있다.[1]3. 3. 3. 메틸화
척추동물에서 류신 카복시 메틸전이효소 1(leucine carboxyl methyltransferase 1) 효소에 의해 C-말단 류신의 카복실기가 메틸화되어 메틸 에스터를 형성한다.[2]3. 4. C 말단 도메인 (CTD)
일부 단백질의 C 말단 도메인(CTD)은 특수한 기능을 가지고 있다. 인간의 경우, RNA 중합효소 II의 CTD는 일반적으로 Tyr-Ser-Pro-Thr-Ser-Pro-Ser 서열의 최대 52개 반복 서열로 구성된다.[7],[3],[5] 이를 통해 다른 단백질이 RNA 중합효소의 C 말단 도메인에 결합하여 중합효소 활성을 활성화할 수 있다. 이러한 도메인은 DNA 전사 개시, 캡핑, RNA 전사체에의 부착, 그리고 스플라이소좀에 대한 RNA 스플라이싱에 관여한다.[8],[4],[6]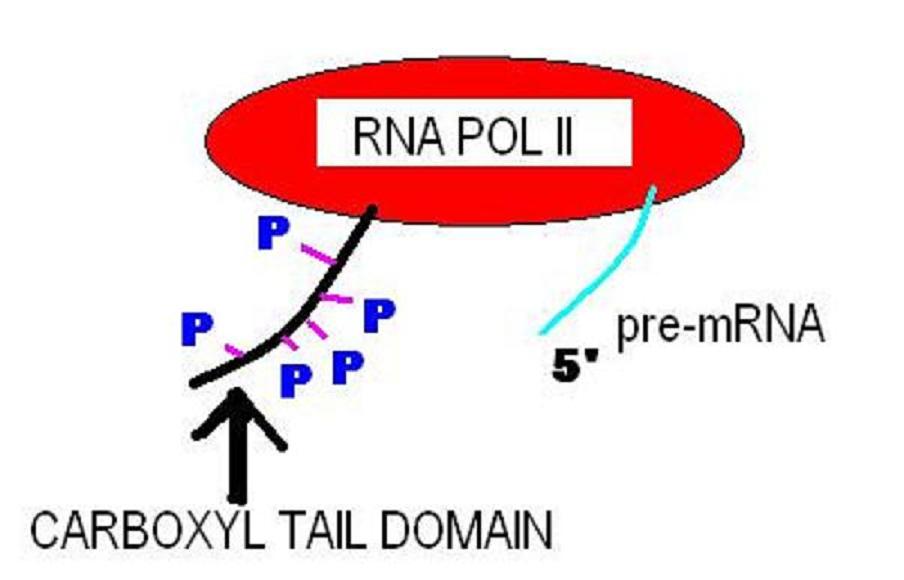
참조
[1]
웹사이트
From RNA to Protein
https://www.ncbi.nlm[...]
Garland Science
2002
[2]
웹사이트
RHEA:48544
https://www.rhea-db.[...]
Swiss Institute of Bioinformatics
[3]
논문
Recognition of RNA polymerase II carboxy-terminal domain by 3'-RNA-processing factors
2004-07-00
[4]
논문
Functional studies of the carboxy-terminal repeat domain of Drosophila RNA polymerase II in vivo
1995-06-00
[5]
웹사이트
Nature
https://www.nature.c[...]
[6]
웹사이트
Functional study of the CTD in Drosophila
http://www.pubmedcen[...]
[7]
논문
Recognition of RNA polymerase II carboxy-terminal domain by 3'-RNA-processing factors
2004-07-00
[8]
논문
Functional studies of the carboxy-terminal repeat domain of Drosophila RNA polymerase II in vivo
https://archive.org/[...]
1995-06-00
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com